Công thức cấu tạo của Phenol C6H5OH. Tính chất hóa học Phenol và bài tập
Trong bài học hôm nay tất cả chúng ta sẽ cùng tìm hiểu vậy phenol có tính Hóa chất, tính chất vật lý gì? công thức cấu trúc và công thức phân tử như vậy nào mà có thể được ứng dụng trong công nghiệp chất dẻo, thuốc sát trùng,…
Công thức cấu trúc của Phenol C6H5OH. Tính Hóa chất Phenol và bài tập thuộc phần: CHƯƠNG 8: DẪN XUẤT HALOGEN – ANCOL – PHENOL
I. Phenol là gì? công thức cấu trúc của Phenol C6H5OH và phân loại
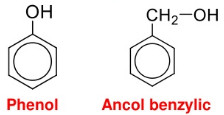
– Phenol là những hợp chất hữu cơ trong phân tử có nhóm OH link trực tiếp với nguyên tử C của vòng benzen.
* Lưu ý: Phân biệt giữa phenol và ancol thơm (phenol có nhóm OH link trực tiếp với C của vòng benzen, ancol có nhóm OH link với C của nhánh).
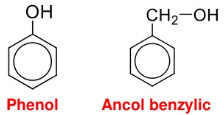
Công thức cấu trúc của phenol và của ancol benzylic
Phân loại phenol
– Những phenol mà phân tử có chứa 1 nhóm -OH thì phenol thuộc loại monophenol. Ví dụ: phenol, o-crezol, m-crezol, p-crezol,…
– Những phenol mà phân tử có chứa nhiều nhóm -OH thì phenol thuộc loại poliphenol.
* Nhận xét: Phenol cũng là tên riêng của hợp chất cấu trúc bởi nhóm phenyl link với nhóm hiđroxyl (C6H5-OH), chất tiêu biểu cho các phenol.
II. Tính chất vật lý của Phenol C6H5OH
– Phenol ít tan trong nước lạnh, tan nhiều trong nước nóng nên dùng để tách bằng phương pháp chiết.
– Là chất rắn, độc, khi để lâu trong không khí bị chảy rữa do hút ẩm và chuyển thành màu hồng.
III. Tính Hóa chất của Phenol C6H5OH
1. Kết cấu của phân tử phenol
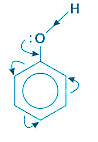
– Phân tử phenol cấu trúc gồm 2 phần: Gốc phenyl (-C6H5) và nhóm chức hydroxyl (-OH).
– Gốc C6H5 hút e làm cho link O-H trong phân tử phenol phân cực hơn link O-H của ancol. Vì vậy, H trong nhóm OH của phenol linh hoạt hơn H trong nhóm OH của ancol và dấu hiệu được tính axit yếu (phenol có tên gọi khác là axit phenic).
– Do có hiệu ứng liên hợp nên cặp e chưa sử dụng của nguyên tử O bị hút về phía vòng benzen làm cho mật độ e của vòng benzen nhất là các vị trí o-, p- tăng trưởng nên phản ứng thế vào vòng benzen của phenol dễ hơn và ưu tiên vào vị trí o-, p- .
2. Tính Hóa chất của Phenol
a) Tính chất của nhóm OH
– Phenol tác dụng với kim loại kiềm (Phenol + Na):
C6H5OH + Na → C6H5ONa + 1/2H2
→ Phản ứng này dùng để phân biệt phenol với anilin.
– Phenol tác dụng với dung dịch kiềm (phenol + NaOH):
C6H5OH + NaOH → C6H5ONa + H2O
– Ancol không có phản ứng này chứng tỏ H của phenol linh hoạt hơn H của Ancol và minh chứng tác động của gốc phenyl đến nhóm OH. Phenol trổ tài tính axit nhưng là axit rất yếu không làm đổi màu quỳ tím, yếu hơn cả axit cacbonic.
C6H5ONa + CO2 + H2O → C6H5OH + NaHCO3
→ Phản ứng này dùng để tách phenol khỏi hỗn hợp anilin và phenol sau đó thu hồi lại phenol nhờ phản ứng với các axit mạnh hơn (Phenol + HCl):
C6H5ONa + HCl → C6H5OH + NaCl
– Phenol bị CO2 đẩy ra khỏi muối → phenol có tính axit yếu hơn axit cacbonic → phenol không làm đổi màu quỳ tím. (dùng axit mạnh đẩy axit yếu ra khỏi muối để minh chứng trật tự tính axit của các chất). Phản ứng này cũng minh chứng được ion C6H5O- có tính bazơ.
b) Phản ứng thế vào vòng benzen
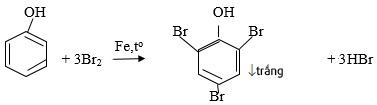
– Thế Brom: phenol tác dụng với dung dịch brom tạo 2,4,6 – tribromphenol kết tủa trắng (phenol+Br2):
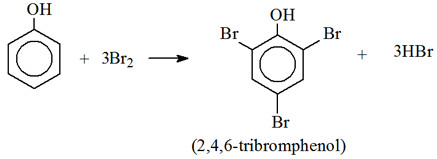
→ Phản ứng này dùng để nhận ra phenol khi không có mặt của anilin và minh chứng tác động của nhóm OH đến khả năng phản ứng của vòng benzen.
– Thế Nitro: phenol tác dụng với HNO3 đặc có xúc tác H2SO4 đặc, đun nóng tạo 2,4,6 – trinitrophenol (axit picric):
C6H5OH + 3HNO3 → C6H2(NO2)3OH + 3H2O
Note: Ngoài phenol, toàn bộ những chất thuộc loại phenol mà còn nguyên tử H ở vị trí o, p so với nhóm OH đều có thể tham gia vào 2 phản ứng thế brom và thế nitro.
c) Phản ứng tạo nhựa phenolfomanđehit
– Phenol + HCHO trong môi trường axit tạo sản phẩm là nhựa phenolfomandehit.
nC6H5OH + nHCHO → nH2O + (HOC6H2CH2)n
– Chuỗi phản ứng tạo nhựa novolac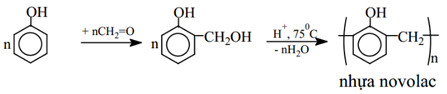
IV. Điều chế Phenol C6H5OH
1. Điều chế phenol từ benzen
C6H6 → C6H5Cl → C6H5ONa → C6H5OH
C6H6 → C6H5CH(CH3)2 → C6H5OH
2. Điều chế phenol bằng phương pháp chưng cất nhựa than đá
– Nhựa than đá + NaOH dư.
– Chiết để lấy lớp nước có C6H5ONa.
– C6H5ONa + HCl → C6H5OH + NaCl
V. Ứng dụng của phenol C6H5OH
+ Phenol được dùng trong nhiều ngành nghề khác nhau:
– Công nghiệp chất dẻo: phenol là nguyên liệu để điều chế nhựa phenol formaldehyde.
– Công nghiệp tơ hóa học: Từ phenol tổng hợp ra tơ polyamide.
– Nông dược: Từ phenol điều chế được chất diệt cỏ dại và kích thích tố thực vật 2,4 – D (là muối natri của axit 2,4 điclophenoxiaxetic).
– Phenol cũng là nguyên liệu để điều chế một số phẩm nhuộm, thuốc nổ (axit picric).
– Do có tính diệt khuẩn nên phenol được dùng để trực tiếp làm chất sát trùng, tẩy uế, hoặc để điều chế các chất diệt nấm mốc (ortho – và para – nitrophenol…)
VI. Bài tập Phenol C6H5OH
Bài 3 trang 193 SGK Hóa 11: Cho 14,0 gam hỗn hợp A gồm phenol và etanol tác dụng với natri dư thu được 2,24 lít khí hidro (đktc)
a. Viết các phương trình hóa học xảy ra.
b. Tính thành phần phần trăm khối lượng của mỗi chất trong A.
c. Cho 14,0 gam hỗn hợp A tác dụng với HNO3 thì thu được bao nhiêu gam axit picric (2,4,6- trinitrophenol)?
* Lời giải bài 3 trang 193 SGK Hóa 11:
– Gọi x và y lần lượt là số mol của C6H5OH và của C2H5OH
a) 2C6H5OH + 2Na → 2C6H5ONa + H2↑
x mol x/2 (mol)
2C2H5OH + 2Na → 2C2H5ONa + H2↑
y mol y/2 (mol)
– Theo bài ra, ta có: 94x + 46y = 14 (*)
– Theo bài ra: nH2 = 2,24/22,4 = 0,1 (mol).
– Theo PTPƯ, ta có: nH2 = (x/2) + (y/2) = 0,1 (**)
– Giải hệ PT gồm (*) và (**) ta được: x = y = 0,1 (mol)
⇒ mC6H5OH = 9,4 (g) ⇒ %mC6H5OH = (9,4/14).100% = 67,1%
⇒ mC2H5OH = 4,6 (g) ⇒ %mC2H5OH = (4,6/14).100% = 32,9%
c) Có PTHH
C6H5OH + 3HNO3 → (NO2)3C6H2OH + 3H2O
0,1 (mol) 0,1 (mol).
⇒ m(NO2)3C6H2OH = 229.0,1 = 22,9 (g).
Bài 4 trang 193 SGK Hóa 11: Cho từ từ phenol vào nước brom; stiren vào dung dịch brom trong CCl4. Nêu hiện tượng và viết các phương trình hóa học.
* Lời giải bài 4 trang 193 SGK Hóa 11:
– Khi phenol và dung dịch brom thì thấy xuất hiện kết tủa trắng
– Cho Stiren vào dung dịch brom trong CCl4 thì thấy dd Brom mất màu.
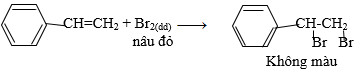
Bài 5 trang 193 SGK Hóa 11: Sục khí CO2 vào dung dịch natri phenolat thấy dung dịch vẩn đục, trong dung dịch có NaHCO3 được tạo thành. Viết phương trình hóa học của phản ứng xảy ra và giải thích. Nhận xét về tính axit của phenol.
* Lời giải bài 5 trang 193 SGK Hóa 11:
– Phương trình phản ứng:
C6H5ONa + CO2 + H2O → C6H5OH↓ + NaHCO3
– Dung dịch bị vẩn đục là do phản ứng tạo ra phenol.
– Nhận xét về tính axit của phenol: Phenol có tính axit yếu hơn nấc thứ nhất của axit cacbonic H2CO3, nên bị axit cacbonic đẩy ra khỏi dung dịch muối.
Bài 6 trang 193 SGK Hóa 11: Viết các phương trình hóa học điều chế:
– phenol từ benzen (1)
– stiren từ etylbenzen (2)
Các chất vô cơ thiết yếu coi như có đủ.
* Lời giải bài 6 trang 193 SGK Hóa 11:
– (1) Điều chế phenol phenol từ benzen:
C6H6 + Br2 C6H5Br + HBr
C6H5Br + 2NaOH đặc C6H5ONa + NaBr + H2O
C6H5ONa + CO2 + H2O → C6H5OH + NaHCO3
– (2) Điều chế stiren từ etybenzen:
– Điều chế etylbenzen từ stiren
C6H5CH2CH3 + Br2 C6H5CHBrCH3 + HBr
C6H5CHBrCH3 + KOH C6H5CH=CH2 + KBr
Công thức cấu trúc của Phenol C6H5OH. Tính Hóa chất Phenol và bài tập – Hóa 11 bài 41 được biên soạn theo sách tiên tiến nhất và Được hướng dẫn biên soạn bởi các thầy thầy giáo dạy Giỏi tư vấn, nếu thấy hay hãy chia sẻ và comment để nhiều bạn khác học tập cùng.



