Công Thức Liên Hệ Giữa Nồng Độ Mol Và Nồng Độ Phần Trăm, Công Thức Tính Số Mol

Nồng độ phần trăm của dung dịch là gì? Và công thức tính nồng độ phần trăm như vậy nào là chuẩn nhất? Nội dung dưới đây, Hóa chất onfire-bg.com sẽ giúp tất cả chúng ta hiểu được khái niệm, ý nghĩa và cách vận dụng công thức tính nồng độ phần trăm để làm bài tập hóa học một cách xuất sắc nhất nhé!
1. Nồng độ là gì?
Nồng độ là khái niệm cho ta biết về lượng hóa chất có trong một hỗn hợp, thường là dung dịch. Dung dịch bao gồm chất tan và dung môi. Nếu chất tan càng nhiều trong một lượng dung môi cố định, thì nồng độ càng cao. Nồng độ sẽ đạt giá trị cao nhất ở những điều kiện môi trường nhất định khi dung dịch bão hòa, có nghĩa là khi đó chất tan không thể hòa tan thêm vào dung dịch được nữa.
Bạn đang xem: Công thức liên hệ giữa nồng độ mol và nồng độ phần trăm
2. Nồng độ phần trăm là gì?
Trong hóa học, nồng độ phần trăm của dung dịch được kí hiệu là C% cho ta biết số gam chất tan có trong 100 gam dung dịch là bao nhiêu.

Nồng độ phần trăm của một chất là gì
3. Công thức tính nồng độ phần trăm
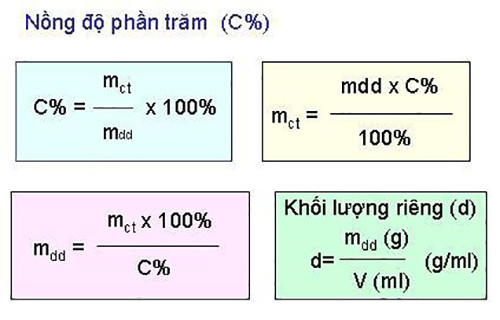
Công thức tính nồng độ phần trăm của một chất
Công thức tính nồng độ phần trăm như sau:
C% = mct/mdd x 100%
Trong số đó:
C%: Nồng độ phần trămmct: Khối lượng chất tanmdd: Khối lượng chất tan
: Nồng độ phần trămKhối lượng chất tan: Khối lượng chất tan
Mặt khác: mdd = mct + mdm (mdm là khối lượng của dung môi)
4. Cách sử dụng công thức tính nồng độ phần trăm
So với hóa học thì có rất nhiều các dạng bài tập khác nhau, có bài yêu cầu tính số mol, khối lượng, hay đơn giản là xác nhận công thức hóa học của từng chất,… Nếu đề bài yêu cầu tính nồng độ phần trăm (C%) các chất có trong dung dịch sau phản ứng thì tất cả chúng ta cần phải thực hiện các bước sau:
Bước 1: xác nhận số chất có trong dung dịch (đặc biệt quan tâm đến số dư của các chất tham gia phản ứng)Bước 2: xác nhận khối lượng dung dịch sau thời điểm tham gia phản ứng theo công thức:
xác nhận số chất có trong dung dịch (đặc biệt quan tâm đến số dư của các chất tham gia phản ứng)xác nhận khối lượng dung dịch sau thời điểm tham gia phản ứng theo công thức:
mdd = khối lượng các chất tan cho vào dung dịch + khối lượng dung môi – khối lượng chất kết tủa – khối lượng chất khí
Bước 3: Tìm khối lượng chất tan cần xác đinhBước 4: Tính C% theo công thức tính nồng độ phần trăm
Tìm khối lượng chất tan cần xác đinhTính C% theo công thức tính nồng độ phần trăm
Chỉ cần thực hiện theo đúng 4 bước trên là tất cả chúng ta có thể tính được nồng độ phần trăm của chất tan rồi. Để nhớ được công thức tất cả chúng ta cùng đi vào một ví dụ cụ thể nhé!
Cách sử dụng công thức tính nồng độ phần trăm cho từng chất
5. Một số lưu ý khi tính nồng độ phần trăm của dung dịch
Để có thể tính được nồng độ phần trăm của dung dịch một cách chuẩn xác nhất, cần lưu ý những điều sau:
Đọc thật kĩ thông tin để có thể xác nhận được những thành phần đã cho, những thành phần cần phải tiến hành tính toán.Cần phải nhớ rõ công thức chuẩn xác để tránh tình trạng nhớ nhầm dẫn theo ứng dụng sai.Khi tính toán thật cẩn trọng để mang ra kết quả tính nồng độ phần trăm đúng nhất.
Đọc thật kĩ thông tin để có thể xác nhận được những thành phần đã cho, những thành phần cần phải tiến hành tính toán.Cần phải nhớ rõ công thức chuẩn xác để tránh tình trạng nhớ nhầm dẫn theo ứng dụng sai.Khi tính toán thật cẩn trọng để mang ra kết quả tính nồng độ phần trăm đúng nhất.
Một số lưu ý cần nhớ khi tính nồng độ phần trăm cho dung dịch
6. Mối quan hệ giữa nồng độ phần trăm và các nồng độ dung dịch khác
Công thức liên hệ giữa nồng độ mol( CM) và nồng độ phần trăm (C%) của chất tan có phân tử khối M là:
CM=10.D.C%/M
7. Nồng độ mol là gì? Công thức tính nồng độ mol
7.1. Khái niệm nồng độ mol và công thức tính
Sau khoảng thời gian hiểu rằng mối quan hệ giữa nồng độ phần trăm với nồng độ mol, chắc hẳn nhiều bạn sẽ thắc mắc về khái niệm nồng độ mol là gì? Và đây chính là câu trả lời.
Nồng độ mol là đại lượng cho biết mối liên hệ giữa số mol của một chất tan và thể tích của dung dịch. Công thức tính nồng độ có thể được xuất phát từ số mol và thể tích, khối lượng và thể tích, hoặc số mol và mililit (ml). Công thức tính nồng độ mol xác nhận như sau:
Công thức tính nồng độ Mol: CM=n/V. Note: cần đổi nhà cung cấp thể tích ml sang lít.
Xác nhận nồng độ mol của dung dịch với số mol và thể tích
Nồng độ mol trổ tài mối liên hệ giữa số mol của một chất tan chia cho thể tích của dung dịch, tính bằng lit. Cụ thể như sau:
Nồng độ mol = số mol chất tan / số lít dung dịch
Xác nhận nồng độ mol của dung dịch từ khối lượng và thể tích
Nồng độ mol trổ tài mối liên hệ giữa số mol của một chất tan với thể tích dung dịch. Cụ thể như sau:
Nồng độ mol = nồng độ chất tan / số lít dung dịch
Xác nhận nồng độ mol của dung dịch từ số mol và ml dung dịch
Với công thức tính nồng độ mol này, bạn cần phải xác nhận số mol của chất tan trong một (l) dung dịch thay vì (ml) dung dịch. Cụ thể, công thức tính C mol như sau:
Nồng độ mol = số mol chất tan / số lít dung dịch
7.2. Một số bài toán tính nồng độ mol
Bài tập 1: Tính nồng độ mol của dung dịch có chứa 0,75 mol Natri Clorua trong 4,2l dung dịch?
Tính nồng độ mol của dung dịch có chứa 0,75 mol Natri Clorua trong 4,2l dung dịch?
Lời giải:
Ta có số mol chất tan là 0,75 mol và thể tích dung dịch là 4,2l. Từ đó, xác nhận được nồng độ mol của dung dịch là:
CM = 0,75 / 4,2 = 0,179 (mol/l)
Bài tập 2: Tính nồng độ mol của dung dịch khi hòa tan 3,4 g KMnO4 trong 5,2l nước.
Tính nồng độ mol của dung dịch khi hòa tan 3,4 g KMnO4 trong 5,2l nước.
Lời giải:
Ta có số mol chất tan KMnO4 = số gam chất tan / phân tử khối của chất tan = 3,4 / 158 = 0,0215 mol. Từ đó, xác nhận được nồng độ mol của dung dịch là:
CM = 0,0215 / 5,2 = 0,004 (mol/l)
Bài tập 3: Tính nồng độ mol của một dung dịch chứa 1,2 mol Canxi Clorua trong 2905ml nước.
Tính nồng độ mol của một dung dịch chứa 1,2 mol Canxi Clorua trong 2905ml nước.
Lời giải:
Ta có 2905ml = 2,905l. Nồng độ mol của dung dịch sẽ là:
CM = 1,2 / 2,905 =0,413 mol/l
Như vậy để tính nồng độ mol của dung dịch, bạn cần xác nhận đúng đắn về số mol chất tan có trong dung dịch, cũng như thể tích của dung dịch đó.
Xem thêm: Các Hệ Tộc Trong Đấu Trường Chân Lý Mùa 4, Dtcl Mùa 4: Danh Sách Hệ Tộc Mùa 4
8. Bài tập ứng dụng tính nồng độ phần trăm
Bài tập 1: Hòa tan hết 20 gam NaCl vào trong 40 gam nước. Hãy tính nồng độ phần trăm của dung dịch này.
Hòa tan hết 20 gam NaCl vào trong 40 gam nước. Hãy tính nồng độ phần trăm của dung dịch này.
Lời giải:
Ta có khối lượng dung dịch là: mdd = mct + mdm = 20 + 40 = 60 gam
Vậy nồng độ phần trăm dung dịch là: C%= x 100% = x 100%= 33,3 %.
Tổng kết: Vậy nồng độ dung dịch của NaCl là 33,3%.
Bài tập 2: Hoà tan 10 gam đường vào 40 gam nước. Hãy tính nồng độ phần trăm của dung dịch thu được.
Hoà tan 10 gam đường vào 40 gam nước. Hãy tính nồng độ phần trăm của dung dịch thu được.
Lời giải:
Ta có khối lượng dung dịch là: mdd = mct + mdm = 10 + 40 = 50 gam
Vậy nồng độ phần trăm dung dịch là: C%= x 100% = x 100%= 20 %.
Tổng kết: Vậy nồng độ dung dịch của đường là 20%
Quá đơn giản phải không các bạn, tuy nhiên để học tốt môn hóa học thì đòi hỏi tất cả chúng ta phải chăm chỉ, có plan và khoa học. Thường xuyên ôn tập các dạng bài tập, nắm chắc lý thuyết, công thức, cho tới cách làm để tìm thấy cách làm đúng đắn và hiệu quả nhất.
Kì vọng, với những thông tin chia sẻ vừa rồi về công thức tính nồng độ phần trăm sẽ giúp các bạn học sinh có thể nắm vững được công thức và giải được các bài tập liên quan đến tính nồng độ phần trăm một cách xuất sắc nhất. Chúc các bạn may mắn.




